摘要
胃肠间质瘤是消化道最常见的间叶源性肿瘤,准确、规范的病理诊断对胃肠间质瘤的临床治疗和预后判断至关重要。中国抗癌协会胃肠间质瘤专业委员会病理学组、中国抗癌协会肿瘤病理专业委员会胃肠间质瘤协作组、中华医学会病理学分会骨和软组织学组及中国研究型医院协会病理分会,组织专家结合国内外有关胃肠间质瘤的病理诊断原则,编写了本临床实践指南,旨在提高我国胃肠间质瘤的病理诊断水平和规范性,为临床治疗和预后判断提供可靠依据。
前言
胃肠间质瘤(GIST)是消化道最常见的间叶源性肿瘤,其发病机制主要为KIT/PDGFRA基因的获得性突变,以甲磺酸伊马替尼(格列卫)为代表的酪氨酸激酶抑制剂(tyrosine kinase inhibitor)在GIST的治疗中取得卓越疗效,GIST已成为精准医疗时代下实体肿瘤靶向治疗的典范,准确、规范的病理诊断对GIST的临床治疗和预后判断至关重要。
本指南结合我国国情以及《中国胃肠间质瘤诊断治疗专家共识(2017版)》和《中国临床肿瘤学会(CSCO)胃肠间质瘤诊疗指南(2021版)》对GIST病理诊断和辅助检查进行较全面地阐述,并给出指导性建议,旨在提高我国GIST的病理诊断和规范化水平。
《中国临床肿瘤学会(CSCO)胃肠间质瘤诊疗指南》已发布2022版。
定义
GIST是指一种好发于消化道的间叶源性肿瘤,在临床上显示不同的生物学行为,以瘤细胞显示卡哈尔间质细胞(interstitial cells of Cajal)分化为特征,免疫组织化学标记显示瘤细胞通常表达CD117和DOG1,分子检测显示大多数病例具有KIT或PDGFRA基因活化突变,少数病例涉及其他分子改变,包括琥珀酸脱氢酶(SDH)亚单位、BRAF、NF1、K/NRAS和PIK3CA等基因突变,以及NTRK3、FGFR1和BRAF等基因重排等。
疾病编码
ICD-O编码:8963/3,ICD-11编码:2B5B&XH9HQ1。
标本前处理和大体检查
标本前处理
-
各类手术标本在固定前应测量肿瘤体积(三维最大径),拍摄新鲜标本的大体形态,包括外观和切面,标本下方应放置标尺。如有假包膜,观察假包膜是否完整,并记录。
-
建有生物样本库的单位经获取患者知情同意后,对于手术切除标本可在固定前留取不影响病理诊断的适量新鲜肿瘤组织,将其放入液氮或移置-80 ℃超低温冰箱保存,以备日后检测和研究之用。
-
内镜下切除标本尽可能在固定前对各切缘进行涂色,以便于病理医师在显微镜下评判切缘情况。
标本固定
- 各类手术标本应在离体后30 min内固定,固定液采用3.7%中性甲醛液(10%中性缓冲福尔马林固定液)。固定液至少3倍于标本体积。
- 对于直径≥2cm的肿瘤组织必须每隔1cm予以切开,以达到充分固定。适宜固定时间为12~48h。
- 各类活检标本取出后应立即固定,固定时间应为6~48h。
标本取材
- 各类手术标本测量固定后肿瘤体积(长径、纵径和横径)。视不同质地和颜色予以充分取材。如有肉眼可见的坏死灶,估算坏死灶占肿瘤的百分比。
- 肿块最大径<2cm者应全部取材;
- 肿块最大径≤5cm者应至少每1cm取材1块,必要时全部取材;
- 肿块最大径>5cm者应每1cm至少取材1块,如最大径为10cm的肿块至少取材10块。
- 靶向治疗后的手术标本需仔细观察原肿瘤部位的改变并进行记录。
- 最大径≤5 cm者应至少每1 cm取材1块,必要时全部取材;
- 最大径>5 cm者应每1 cm至少取材1块,并最大剖面完全取材(图1,2);
- 肿瘤结节不明显者,对疑似肿瘤病灶全部取材。有条件者也可尝试大切片。
推荐取材组织块体积不大于2.0 cm×1.5 cm×0.3 cm。
- 送检活检标本必须全部取材。组织过小者(如穿刺标本)应包于纱布或柔软的滤水纸中以免丢失,必要时加以染料标记。
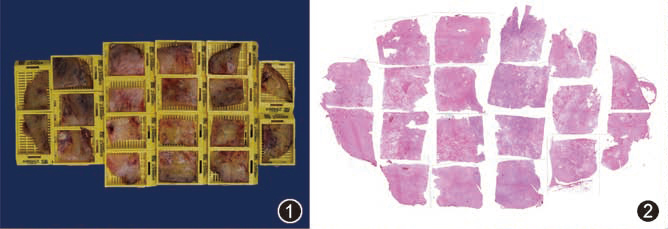
图1 靶向治疗胃肠间质瘤(GIST)整个切面取材
图2 整个切面取材后切片拼接 HE 低倍放大
取材后的标本处理
-
取材剩余组织为避免腐变,应始终保存于足量且足够浓度的甲醛固定液中,以备诊断过程中或诊断报告签发后的标本复查或补充取材之需。
-
如病理诊断明确为GIST,CD117和DOG1标记均呈弥漫强阳性者,可补取适当肿瘤组织,制成3~5mm方形或条状组织块,作为免疫组织化学标记的阳性对照。
-
剩余标本在病理诊断报告签发2周后,未接到临床反馈信息,未发生因外院会诊意见分歧而要求复审等情形下,可由医院按相关规定处理。
组织病理学诊断
根据肿瘤细胞的形态将GIST分为梭形细胞型、上皮样型和梭形细胞-上皮样混合型3种主要亚型。少见类型包括去分化型。此外,肿瘤间质也可有胶原化、骨化/钙化、黏液样变、炎性细胞浸润、出血坏死和囊性变等改变。
梭形细胞型
📊占50%~70%。主要由形态相对一致的梭形细胞组成,瘤细胞的密度、异型性和核分裂象因病例而异(图3)。部分GIST病例于核端可见空泡(图4)。梭形细胞多呈束状或交织状排列,有时可见器官样、假菊形团样或栅栏状等多种排列方式。少数病例瘤细胞可显示有多形性(图5)。
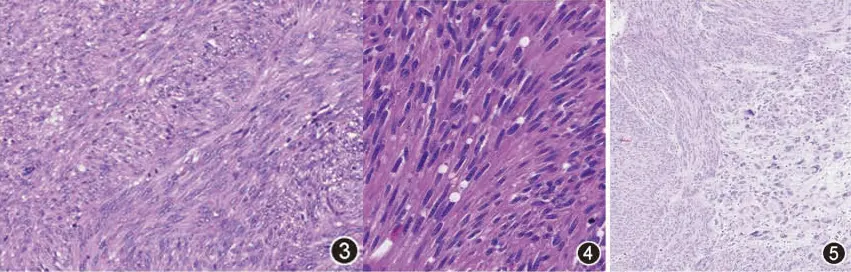
图3 梭形细胞型GIST HE 高倍放大
图4 GIST肿瘤细胞核端空泡 HE 高倍放大
图5 部分区域瘤细胞显示多形性 HE 中倍放大
上皮样型
占20%~40%。瘤细胞呈上皮样、圆形或多边形(图6),胞质可淡染、嗜伊红色或透亮状,少数病例可呈印戒细胞样或蜘蛛网状细胞样(图7)。瘤细胞多呈弥漫片状、巢状或结节状排列。少数病例瘤细胞可显示有多形性(图8)。
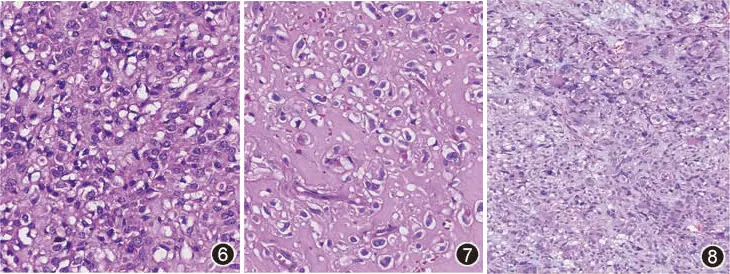
图6 上皮样GIST HE 高倍放大
图7 上皮样GIST中的瘤细胞呈空泡状 HE 高倍放大
图8 上皮样GIST中的瘤细胞显示多形性 HE 中倍放大
梭形细胞-上皮样混合型
占10%。由梭形细胞和上皮样细胞混合组成,两种成分之间可有相对清楚的界限(图9),或有移行(图10)。
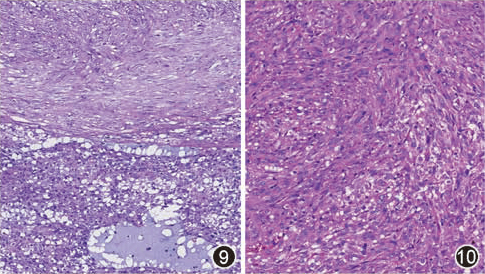
图9 混合型GIST,上皮样和梭形细胞成分之间分界清楚 HE 低倍放大
图10 上皮样细胞和梭形细胞之间有移行 HE 中倍放大
去分化型
GIST中出现非GIST的高级别去分化成分,可为横纹肌肉瘤(图11)、血管肉瘤、多形性未分化肉瘤或其他少见的肉瘤类型。可发生于原发性GIST或靶向治疗后GIST。
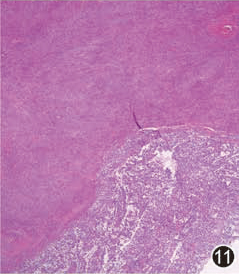
图11 去分化GIST,右下方为横纹肌肉瘤区域,左上方为经典GIST区域HE低倍放大
肿瘤间质改变
(1)胶原化或玻璃样变(图12),明显时可呈硬化性改变,小肠GIST中常可见丝团样纤维(skeinoid fiber,图13);
(2)钙化或骨化;
(3)黏液样变(图14);
(4)较多的炎性细胞浸润(图15);
(5)出血和囊性变(图16);
(6)坏死,并常见瘤细胞围绕血管生长(图17)。
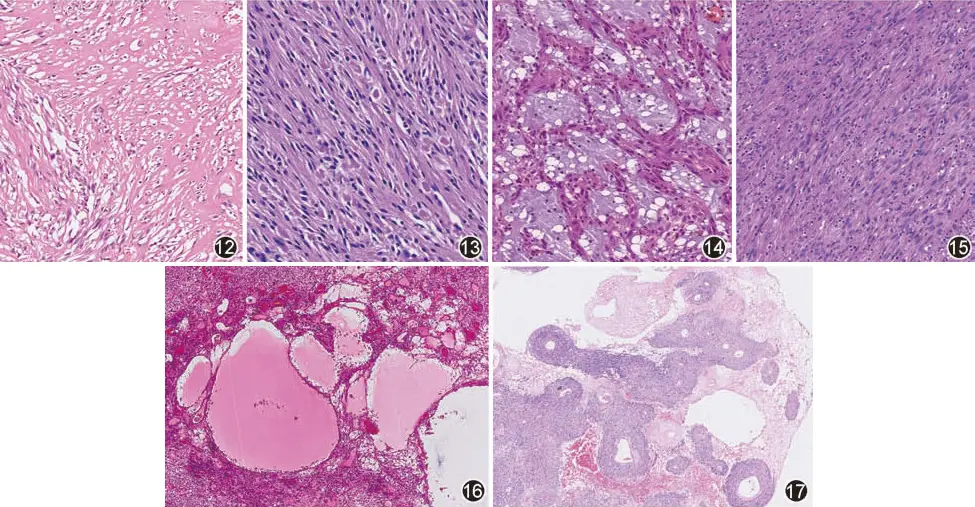
图12 间质伴有胶原化 HE 中倍放大
图13 小肠GIST间质内可见丝团样纤维(skeinoid fiber)HE 高倍放大
图14 间质黏液样变 HE 中倍放大
图15 间质内淋巴细胞浸润 HE 中倍放大
图16 胃肠间质瘤肿瘤间质改变,出血和囊性变 HE 低倍放大
图17 瘤细胞围绕血管呈周皮细胞瘤样,周边伴有坏死 HE 低倍放大
靶向治疗后的病理形态和病理学效应评估
具体内容请点击:👉https://www.fzbl.top/archives/gistpg
免疫组织化学标记
阳性对照:CD117和DOG1标记需加用阳性对照(图21)。

图21 免疫组织化学加用阳性对照,瘤细胞弥漫性表达CD117和DOG1
-
各类活检标本:因活检组织较少,如临床怀疑GIST,病理医师也考虑GIST时直接采用CD117和DOG1标记(胃镜活检镜下呈上皮样或混合型形态时需加做SDHB),如阳性则还可有剩余组织用于尝试分子检测。不宜采用过多免疫组织化学标记用于鉴别诊断,以尽可能地减少组织损耗,以备后续分子检测所需。对活检标本切片时可连续切15张左右白片备用。另保留切片修理蜡块时所产生的蜡屑,可置于Appendorf管内,留作分子检测备用材料。
-
手术切除标本:病理形态首先考虑GIST时应先采用CD117和DOG1两个必做标记。如肿瘤发生于胃,特别是发生于儿童和青年女性患者的上皮样型或混合型GIST,加用SDHB标记。SDHB阴性者,有条件可加做SDHA标记,表达缺失提示SDHA基因突变。另常规加用CD34和Ki-67标记。PDGFRA标记对预示PDGFRA基因突变有潜在性价值,但最终诊断仍需分子检测明确。
-
CD117/DOG1标记阳性但KIT/PDGFRA基因突变阴性病例,在除外SDH缺陷型GIST后可尝试加做BRAF(推荐检测抗体为克隆号VE1)和panTRK(推荐检测抗体为克隆号EPR17341),作为免疫组织化学筛查,但仍需分子检测明确。
-
标记结果判断:采用阳性和阴性,不采用半定量方式。CD117和DOG1阳性多定位于胞质,约半数可同时呈点状(高尔基式)染色,少数可仅为点状或膜染色。大多数GIST均弥漫强阳性表达CD117和DOG1,少数病例(如D842V突变型等)CD117标记可为灶性弱阳性或阴性(图22),但DOG1标记为阳性。DOG1标记有助于诊断CD117阴性GIST病例,特别是上皮样型(图23)。极少数病例CD117阳性但DOG1阴性,以及CD117和DOG1双阴性,诊断GIST需依赖于分子检测。
免疫组化标记:CD117、DOG1、CD34、SDHB、SDHA、PDGFRA、BRAF(VE1)、panTRK(EPR17341)、Ki67
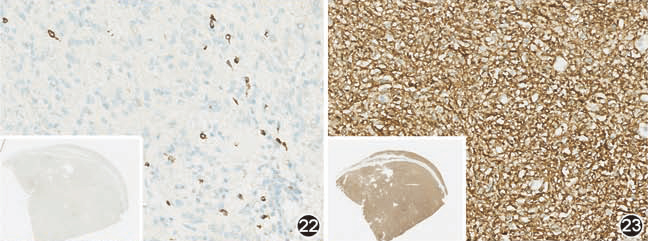
图22 D842V突变上皮样GIST中的瘤细胞CD117标记为阴性 EnVision法 高倍放大
图23 与图22同一病例,瘤细胞弥漫表达DOG1 EnVision法 高倍放大
分子病理检测
标本类型
适合分子检测的标本包括各类活检和手术切除标本。备有生物样本库的单位或机构,可采用冻存新鲜肿瘤组织或已经提取保存的DNA。
适应人群
- 活检病理证实为GIST,术前拟行靶向治疗
- 原发可切除GIST,术后评估为中-高危拟行靶向治疗者
- 复发性或转移性GIST
- 继发耐药性GIST
- 常规病理诊断困难者
GIST的分子检测也可应用于
- 鉴于GIST恶性潜能及后续潜在治疗的需求,对低危和极低危GIST也可考虑基因测序;
- 同时或异时多发性GIST,可分别同时加以分子检测,部分病例可显示出不同的基因突变类型。
- 对晚期不能进行组织活检的患者,在获取患者知情同意后可尝试液体活检检测循环肿瘤DNA(circulating tumor DNA),但目前液体活检在GIST领域仍处于探索研究阶段,检测结果可供参考,尚不能单纯依靠液体活检结果指导GIST诊治。
分子检测内容
-
常规检测:包括KIT基因第9、11、13、17号外显子和PDGFRA基因第12、14和18号外显子。
-
继发突变肿瘤:加做KIT基因第14和18号外显子检测。KIT基因继发性突变较为多见,多位于ATP结合区(第13及14号外显子)或活化环(第17及18号外显子);PDGFRA基因继发性突变相对少见,可为第18或14号外显子。
-
野生型GIST:分子检测包括SDH亚单位(A/B/C/D)、BRAF、NF1、K/NRAS和PIK3CA等基因突变检测,FGFR1、NTRK3、BRAF和ALK等基因重排检测。
检测基因突变包括:KIT、PDGFRA、SDHA、SDHB、SDHC、SDHD、BRAF、NF1、K/NRAS和PIK3CA;检测基因重排包括:FGFR1、NTRK3、BRAF、ALK。其中SDHA、SDHB、SDHC、SDHD、NF1检测胚系变异,SDH亚单位多为胚系变异,Carney三联征涉及SDHC表观突变(促进子甲基化),其他基因检测体系变异。NTRK3、BRAF基因重排可采用FISH检测,或加做FISH用以验证NGS检测结果。
分子检测方法
目前在尚无国家药品监督管理局(NMPA)批准的GIST分子检测试剂盒情况下,采用实验室自建项目(LDT)验证试剂进行分子检测。
- 一代测序:目前对经典型GIST的分子检测主要采用一代测序(Sanger测序)。
- 二代测序:病理诊断明确但一代测序检测阴性的GIST可加做二代测序。除KIT和PDGFRA基因外,二代测序中的基因组应包含野生型GIST所涉及的基因突变类型和基因重排类型。NTRK3重排GIST可采用panTRK免疫组织化学初筛后经荧光原位杂交(FISH)检测证实,或经二代测序检测后再采用FISH对检测结果加以验证。
分子检测结果解读
- 一代测序:应明确基因突变位点及其类型,对辅助靶向治疗和判断预后有重要意义。
如KIT基因第11号外显子突变GIST患者中,缺失突变或插入缺失突变患者的预后较点突变和重复突变患者差,缺失突变中第557~558号密码子缺失突变及多个密码子缺失患者术后预后较差;PDGFRA基因第18号外显子D842V突变对甲磺酸伊马替尼原发耐药。
- 二代测序:分子生物信息学应符合《临床分子病理实验室二代基因测序检测专家共识》和《二代测序技术在肿瘤精准医学诊疗中的应用专家共识》等共识的基本要求,配备完善的标准分析及质量控制流程。
基因突变与靶向疗效的相关性
-
KIT突变:第13号外显子突变相对其他外显子突变预后较好。第11号外显子缺失突变较非缺失突变预后差,特别是第557~558号密码子缺失突变者生物学行为较其他缺失突变更差。第9号外显子突变型GIST对甲磺酸伊马替尼敏感性相对较差。
-
PDGFRA突变:PDGFRA突变型GIST整体预后较好,但第18号外显子D842V突变型GIST对甲磺酸伊马替尼及舒尼替尼等均原发耐药,阿伐替尼对该类型晚期GIST具有良好效果。
-
SDH缺陷型GIST:对甲磺酸伊马替尼反应差,具有抑制肿瘤血管生成作用的靶向药物如舒尼替尼或瑞戈非尼在部分患者中可能有一定治疗效果。
其他分子改变
- 早期最常见的遗传学改变为14q丢失,可见于60%~70%的GIST,主要涉及MAX(MYC-associated factor X)基因失活性突变,导致p16失活突变和影响细胞周期(包括CDKN2A、TP53和RB1基因等),其他遗传学异常包括22q(~50%)、1p(~50%)和15q(~40%)丢失。
- 晚期遗传学改变主要为位于Xp21.1上的肌萎缩蛋白基因(dystrophin)失活,可见于90%的转移性GIST。高危GIST可有CDKN2A、TP53和RB1失活突变。
野生型GIST
野生型GIST指的是病理诊断符合GIST但分子检测无KIT/PDGFRA基因突变者。约85%儿童GIST和10%~15%成人GIST为野生型GIST。
根据是否有SDHB表达缺失分为两大类,参见图24。
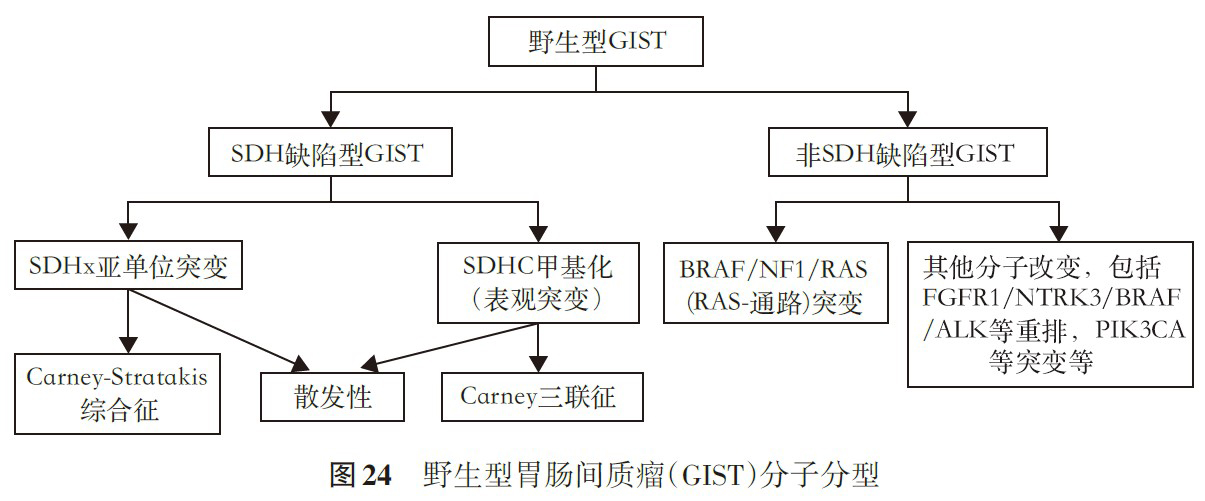
1.SDH缺陷型GIST:从分子改变上包括SDHx亚单位突变和SDHC甲基化(表观突变),从临床上,包括散发性、Carney三联征相关性和Carney-Stratakis综合征相关性GIST。
-
散发性:发生于儿童和青年人,女性多见。肿瘤发生于胃,镜下常呈多结节性或丛状生长方式(图25),瘤细胞呈上皮样(图26),也可为混合型,约50%病例可见淋巴管内瘤栓,约10%病例可见区域淋巴结内转移(图27)。免疫组织化学标记显示瘤细胞表达CD117和DOG1,但SDHB失表达(图28)。分子检测显示约半数病例SDH亚单位(SDHA、SDHB、SDHC或SDHD)功能丧失性胚系突变,其中约30%为SDHA突变(多为胚系突变),免疫组织化学SDHA失表达,20%为SDHB、SDHC或SDHD突变。另半数病例SDHC增强子高甲基化和SDH复合体表观基因沉默,常过表达胰岛素样生长因子受体1R(IGF1R)。
-
Carney三联征相关性GIST:非遗传性,无家族性,可伴发肺软骨瘤(常为多灶性)和肾上腺外副神经节瘤,仅22%病例同时合并3种肿瘤,53%同时有GIST和肺软骨瘤,24%同时有GIST和副神经节瘤。其他伴发性肿瘤包括嗜铬细胞瘤、肾上腺皮质腺瘤和食管平滑肌瘤。绝大多数为女性,中位年龄15岁。常发生于胃,多灶性,呈多结节性或丛状生长,主要为上皮样型。由SDHC甲基化所致,免疫组织化学SDHB失表达,SDHA表达保留。
-
Carney-Stratakis综合征相关性GIST:是一种常染色体显性遗传性疾病,不全外显。可分为完全性(同时有GIST和副神经节瘤)和不完全性(仅有GIST),不完全性可能发展为完全性。中位年龄23岁,表现为胃多发性GIST,主要为上皮样型,容易发生淋巴结转移。由SDHB(10%)、SDHC(80%)和SDHD(10%)胚系失活性突变所致,突变导致蛋白表达丢失,免疫组织化学SDHB失表达。
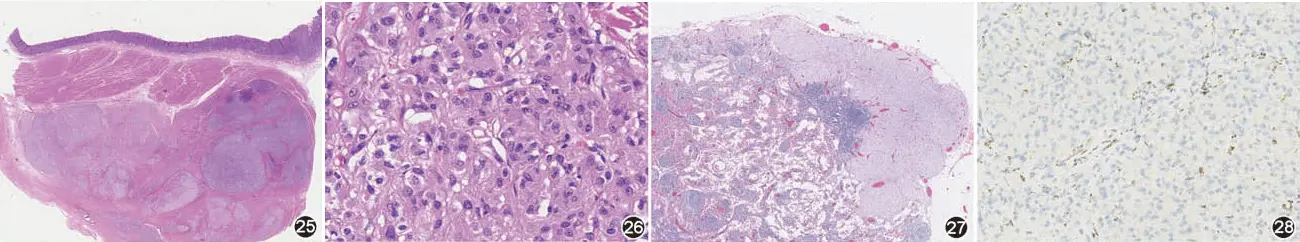
图25 SDH缺陷型GIST呈多结节性 HE 低倍放大
图26 SDH缺陷型GIST,呈上皮样形态 HE 高倍放大
图27 SDH缺陷型GIST,区域淋巴结转移 HE 低倍放大
图28 SDH缺陷型GIST,瘤细胞失表达SDHB EnVision法 高倍放大
2.非SDH缺陷型GIST:比较少见,包括
- BRAF突变型GIST:好发于小肠,其次为胃。组织形态上多为梭形细胞型,免疫组织化学标记仍显示CD117和DOG1阳性。分子检测显示BRAF基因第15号外显子(p.V600E)突变。少数情况下为耐药性二次突变。BRAF免疫组织化学抗体(克隆号VE1)可帮助识别BRAF突变型GIST。
- Ⅰ型神经纤维瘤病(NF1)相关性GIST:常染色体显性遗传,中位年龄49岁,常伴有NF1相关临床表现,皮肤色素沉着、牛奶咖啡斑、多发性神经纤维瘤和副神经节瘤等。多发生于空肠和回肠,常为多结节性,肿瘤体积小,核分裂活性低,常伴有卡哈尔间质细胞增生。分子检测显示NF1功能丢失性胚系突变,但无热点突变,可为插入/缺失或框内移位突变、错义突变。生物学行为相对惰性。
- KRAS/NRAS突变型GIST:原发耐药GIST或KIT/PDGFRA突变型GIST可发生RAS突变。
- 其他:包括产生ETV6-NTRK3、FGFR1-HOOK3、FGFR1-TACC、BRAF-AGAP3、BRAF-MKRN1和PPP1R21-ALK等融合基因,或PIK3CA等基因突变。
家族性GIST
家族性GIST在GIST占比不足5%,多为常染色体显性遗传,主要表现为胃肠道多发性GIST,并有多种伴随的临床症状或体征,主要由KIT或PDGFRA基因胚系突变引起,少数为SDH或NF1基因胚系突变。家族性GIST的诊断主要依赖于家族史、病理诊断和基因检测。临床上,对胃肠道多发性GIST患者,应仔细询问病史,尤其是家族史,并进行详细的体检和全面的影像学检查。若病理诊断符合GIST,且存在家族史和特征性的临床表现,外周血或其他正常组织/细胞中检测出KIT、PDGFRA、SDH或NF1胚系突变,即可诊断家族性GIST。对于家族性GIST,还应重视疾病筛查,针对具体的临床表现,进行特定基因的遗传学检测,一旦发现胚系突变,需对其直系亲属进行该特定位点的逐级遗传学筛查。对存在胚系突变的患者亲属,应定期进行内镜和影像学检查,必要时行组织学活检,以早期发现、早期诊断和早期治疗。
-
KIT胚系突变家族性GIST:中位发病年龄40~50岁。患者常表现为吞咽困难、皮肤色素沉着和色素痣等,偶可伴有多发性非GIST性肿瘤。最常见于胃和小肠,少数为食管和直肠。多为梭形细胞型,伴弥漫性卡哈尔间质细胞增生。第11号外显子突变最常见(约占68%),以点突变为主(约60%),其次为缺失和插入/缺失(约30%),并富含p.V559A、p.W557R和p.L576P(约50%);部分为第13、17、8和9号外显子突变。
-
PDGFRA胚系突变家族性GIST:非常少见,检索到文献报道不足10例。中位年龄40~50岁,临床上常伴有面部和皮肤粗糙、牙齿过早脱落、胃肠道炎性纤维性息肉、胃肠道脂肪瘤和巨手症等。好发于胃,上皮样型为主,无弥漫性卡哈尔间质细胞增生。显示PDGFRA第12、14和18号外显子突变,但尚未见第18号外显子c.2525A>T(D824V)的报道。
-
NF1相关性GIST和Carney-Stratakis综合征相关性GIST:详见上述。
GIST诊断思路
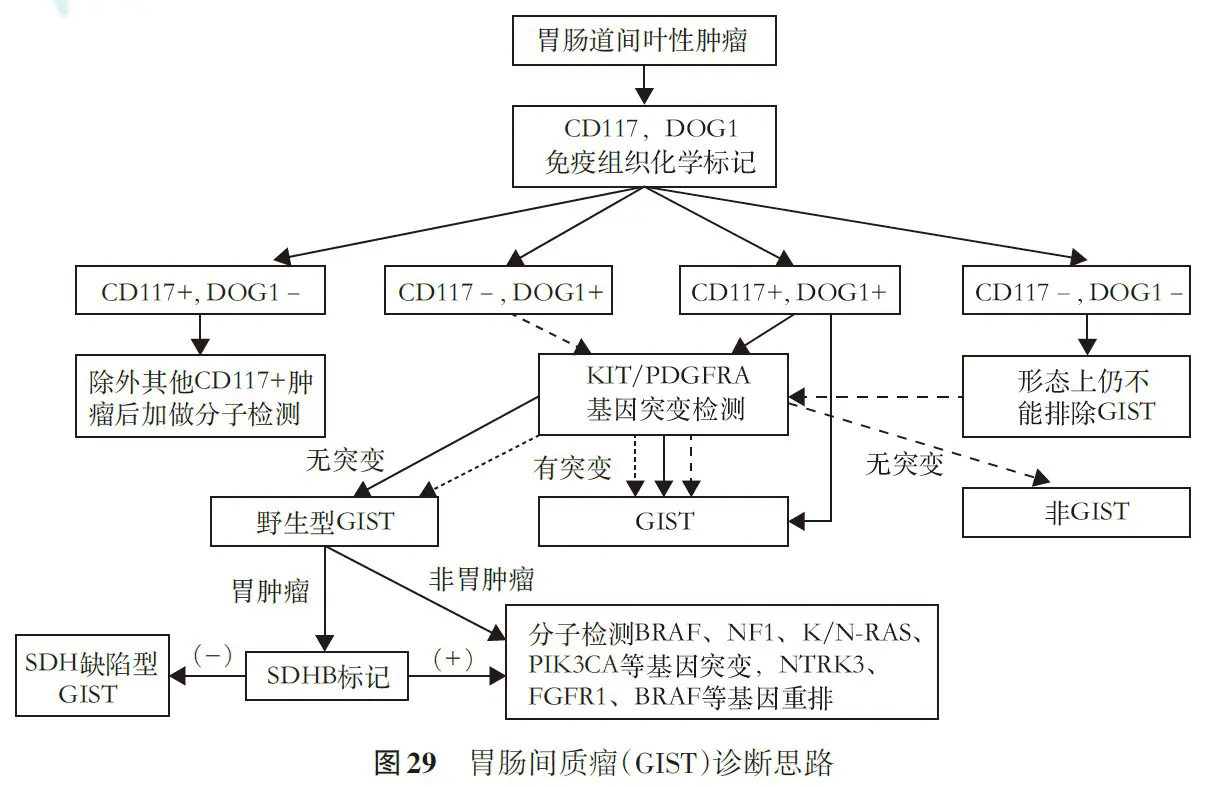
从事GIST病理诊断的医师必须熟悉GIST的各种形态,合理解读CD117和DOG1标记结果,熟悉GIST的分子改变,并对野生型GIST有所了解。已经开展亚专科病理建设的单位,建议由专科病理医师从事GIST的病理诊断。对少见类型或特殊类型可请其他单位会诊、通过多学科或专科学组讨论,以达到精准诊治。
GIST的诊断思路参见图29。
危险度评估和TNM分期
危险度评估 请点击:👉https://www.fzbl.top/archives/gistwxd
TNM分期 请点击:👉https://www.fzbl.top/archives/gisttnm
GIST病理诊断报告内容和规范
GIST的病理报告应该规范化,必须准确地注明肿瘤原发部位、肿瘤大小、核分裂象计数(/5 mm^2^)和肿瘤破裂等情况。一些临床病理形态指标(如血管浸润、神经浸润、脂肪浸润、黏膜浸润、肿瘤性坏死、异型性、肌层浸润、围绕血管呈周皮细胞瘤样等)可反映在GIST病理报告中,这些形态学指标对判断GIST的生物学行为可能有一定的价值。病理报告中应附有免疫组织化学标记结果,分子检测结果可另附。
推荐的GIST手术标本(术前未经靶向治疗者)的病理报告参见表4,靶向治疗后GIST病理报告参见表5。

表4 胃肠间质瘤病理诊断报告

表5 靶向治疗后胃肠间质瘤病理诊断报告
以上内容版权归中华医学会杂志社所有。